
技術文章
 更新時間:2025-09-18
更新時間:2025-09-18 點擊次數:31
點擊次數:31
作為每天要幫實驗室客戶解決各種 Transwell 問題的實驗耗材供應商,我見過太多同學因為操作細節沒把控好,明明細胞狀態沒問題,最后卻得不到能用的數據 —— 要么膜上細胞太少,要么下室細胞污染,甚至連 Transwell 小室怎么放都能搞錯。

其實細胞遷移實驗本身不復雜,但90% 的失敗都藏在 “不起眼" 的細節里。今天就從 “耗材準備 - 細胞處理 - 實驗操作 - 結果統計" 全流程,把我總結的實操要點和避坑經驗分享給大家,新手照著做,基本能一次出有效數據。
一、實驗前:耗材和試劑準備,這些 “預處理" 別省
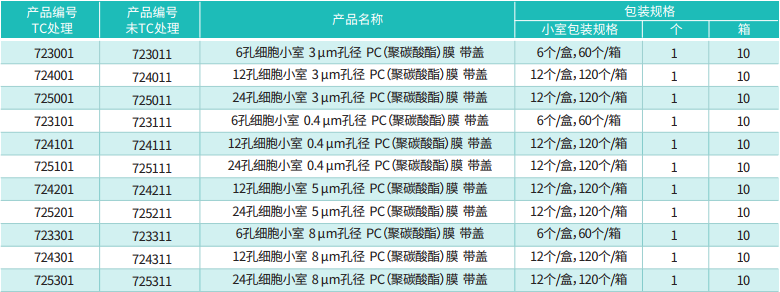
很多人拿到 Transwell 小室就直接用,其實第一步 “預處理" 沒做好,后續再努力也白費。先明確:我們常用的 Transwell 小室(遷移實驗用無基質膠的,侵襲實驗才加 Matrigel),核心是聚碳酸酯膜(孔徑一般選 8μm,除非細胞特別大 / 小,比如神經元可能用 12μm),實驗耗材膜的處理和試劑配比是關鍵。
1. Transwell 小室的預處理:別讓 “氣泡" 毀了實驗
• 第一步:激活膜的親水性
新的小室膜是疏水的,細胞沒法附著遷移,必須先用水或培養基浸潤激活。操作時用無菌槍頭吸取無血清培養基(或 PBS),緩慢加到小室內部(膜上方),注意別戳到膜!加完后放在培養板孔里,室溫靜置 20-30 分鐘,讓膜充分吸水變親水。
? 避坑:別用血清培養基激活!血清里的蛋白會提前吸附在膜上,反而影響細胞遷移。
• 第二步:去除膜上殘留液體
激活后,用無菌吸頭輕輕吸掉小室內部的培養基(動作要輕,別把膜吸破),再把小室倒扣在無菌濾紙上吸 10 秒,把膜上多余的液體吸干 —— 殘留液體太多,會導致上室細胞懸液被稀釋,影響細胞密度。
2. 試劑配比:血清濃度是 “遷移動力",別亂加
Transwell 遷移的原理是 “趨化作用":下室的血清(營養)吸引上室的細胞穿過膜,所以上下室的血清濃度差是關鍵,配比錯了細胞根本不遷移。
• 上室:無血清培養基(或含 0.1%-0.5% 血清,避免細胞饑餓過度,但濃度絕對不能高于下室)
• 下室:含 10%-20% 血清的培養基(根據細胞類型調整,比如腫瘤細胞用 10% 足夠,成纖維細胞可能需要 20%)
?? 重點:下室加培養基時,要先加到培養板孔里,再放入預處理好的小室,避免小室下方產生氣泡 —— 氣泡會頂住膜,細胞穿不過去,最后下室沒細胞,白做!

二、細胞處理:狀態比數量更重要,這 3 步別錯
很多同學糾結 “上室加多少細胞",其實比數量更重要的是細胞狀態—— passages 太多、有污染、貼壁不牢的細胞,遷移能力會差很多,數據根本不可信。
1. 細胞消化:別消化過度,避免損傷細胞膜
• 用胰酶消化時,看到細胞邊緣收縮、輕輕吹打能散開就停,立刻加含血清的培養基終止消化(血清能中和胰酶)
• 別用槍頭猛吹,避免細胞破裂 —— 破裂的細胞會沉在膜上,最后計數時會算成 “遷移細胞",導致數據偏高。
2. 細胞計數:調整濃度,保證膜上細胞均勻
• 消化后的細胞離心(1000rpm,5 分鐘),棄上清,用無血清培養基重懸(和上室培養基一致),吹成單細胞懸液
• 計數后調整濃度:一般上室加 2-5×10?個細胞 / 孔(24 孔板),具體看細胞大小 —— 比如 A549 細胞小,加 5×10?;HCT116 細胞大,加 2×10?。
? 技巧:如果不確定濃度,先做預實驗(比如設 2、4、6×10?三個梯度),選 “24 小時后膜上還有少量未遷移細胞,下室有明顯遷移細胞" 的濃度。
3. 上室加樣:別讓細胞堆積在中間
• 加細胞懸液時,槍頭貼著小室內壁緩慢加(別直接滴在膜上),加完后輕輕晃一下小室,讓細胞均勻分布在膜上
• 上室液體體積:24 孔板的小室,一般加 200μL(別加滿,留一點空間,避免液體溢出到下室)
• 加完后把培養板放進孵箱,前 30 分鐘別碰—— 讓細胞先貼在膜上,避免移動導致細胞聚堆。
三、孵育和染色:時間別亂定,染色步驟要 “輕"
孵育時間和染色方法,直接影響最后能不能清晰計數,新手常在這里踩坑。
1. 孵育時間:根據細胞類型定,別盲目跟文獻
• 大多數腫瘤細胞(如乳腺癌、肺癌細胞)孵育 24 小時足夠;成纖維細胞遷移快,12-16 小時就夠;內皮細胞慢,可能需要 36 小時
• 怎么判斷時間到了?可以在孵箱里觀察:用顯微鏡看小室膜下方,有明顯細胞附著就可以終止,別孵育太久 —— 否則下室細胞太多,會重疊在一起,沒法計數。
2. 固定和染色:別把膜弄破,別漏染
• 第一步:棄液
取出小室,先倒掉上室的培養基,再用 PBS 輕輕洗 2 次(別用勁沖,避免把膜上的細胞沖掉)
• 第二步:固定
用 4% 多聚甲醛(PFA)加滿上室,室溫固定 20 分鐘(固定是為了讓細胞貼在膜上,后續染色不會掉)
• 第三步:染色
棄掉 PFA,用 PBS 洗 2 次,然后加 0.1% 結晶紫染液(過濾后用,避免有雜質),室溫染 15-20 分鐘 —— 結晶紫是細胞核染色,顏色深,計數清晰。
? 避坑:染色后一定要用 PBS 輕輕洗去多余染液,直到洗出的水變清 —— 否則背景顏色太深,細胞和膜分不清。
3. 擦去上室未遷移細胞:這步是 “數據準確" 的關鍵
• 染色后,用無菌棉簽(或細胞刮子)輕輕擦去小室上表面的細胞(這些是沒遷移過去的),擦的時候要順著一個方向,別來回蹭 —— 避免把膜擦破,或者把下表面的遷移細胞擦掉。
• 擦完后可以在顯微鏡下看一眼:上表面沒殘留細胞,下表面有紫色的細胞,就說明擦干凈了。
四、結果統計:別只數 1 個視野,這樣才客觀
很多人隨便找個視野數細胞,最后數據波動大,審稿人根本不認可。正確的統計方法,要保證 “隨機性" 和 “重復性"。
1. 拍照:選 5 個固定視野,避免主觀選擇
• 這個步驟一般用不到那種精密的實驗室儀器,我們把小室放在生物顯微鏡下,用 10× 物鏡(視野大,計數方便),拍上、下、左、右、中 5 個視野(每個視野間距盡量一致),別只拍細胞多的地方 —— 否則數據偏高,不客觀。
• 拍照時保持曝光一致:同一個實驗的所有樣本,曝光時間、焦距都要一樣,避免后續分析時因亮度不同導致計數誤差。
2. 計數:手動計數 + 軟件分析,雙重驗證
• 手動計數:用 ImageJ 軟件打開圖片,用 “Cell Counter" 插件,逐個視野數細胞(紫色的細胞核都算),5 個視野取平均值
• 軟件分析:如果樣本多,可以用 ImageJ 的 “Threshold" 功能,設置合適的閾值(把細胞和背景分開),然后用 “Analyze Particles" 自動計數,最后和手動計數對比,誤差在 10% 以內就可以用。
?? 注意:如果細胞重疊太多(比如孵育時間太長),自動計數會不準,必須手動計數,或者在染色前用胰酶把下室的細胞消化下來,用流式細胞儀計數(更準確,但步驟多)。
3. 重復實驗:至少 3 次獨立重復,別偷懶
• 單個樣本做 3 個復孔(比如對照組 3 孔,處理組 3 孔),然后至少做 3 次獨立實驗(不同天做),最后用 “平均值 ± 標準差(SD)" 表示數據,用 t 檢驗或 ANOVA 做統計分析 —— 這樣數據才有統計學意義,審稿人才會認可。
五、常見問題排查:做不出數據?先看這 5 點
最后總結幾個客戶常問的問題,幫大家快速定位問題所在:
問題現象 | 可能原因 | 解決辦法 |
下室幾乎沒有細胞 | 1. 小室下方有氣泡;2. 上下室血清濃度差反了 | 1. 下室先加培養基,再放小室;2. 確認上室無血清,下室有血清 |
上室細胞全沒了 | 1. 擦細胞時太用力;2. 固定時間不夠 | 1. 用棉簽輕輕擦,別蹭膜;2. 多聚甲醛固定至少 20 分鐘 |
細胞重疊嚴重,沒法計數 | 1. 上室細胞加太多;2. 孵育時間太長 | 1. 減少細胞濃度(比如從 5×10?降到 2×10?); 2. 縮短孵育時間 |
背景顏色深,細胞看不清 | 1. 結晶紫沒過濾;2. 染色后沒洗干凈 | 1. 染液用 0.22μm 濾膜過濾;2. 用 PBS 多洗幾次,直到水變清 |
不同復孔數據差異大 | 1. 細胞懸液沒吹勻;2. 加樣時細胞聚堆 | 1. 重懸細胞時多吹幾次,保證單細胞懸液;2. 加樣后輕輕晃小室 |
其實 Transwell 遷移實驗,只要把 “膜的預處理、血清濃度差、細胞狀態、計數方法" 這幾個關鍵點把控好,就能穩出數據。如果還有其他問題,比如不知道選哪種孔徑的小室,或者需要匹配特定細胞的實驗耗材,也可以進入蘇州阿爾法生物咨詢我 —— 畢竟我們每天和這些實驗耗材打交道,對不同細胞的適配性還是很熟的。
最后提醒一句:實驗過程中做好記錄(比如細胞濃度、孵育時間、染色時間),下次再做就能直接復用參數,不用再從頭摸索啦~